MDシミュレーション
生命現象には全て生体高分子(特に蛋白質・DNA・RNA)の動的な構造変化が密接に関連しています.これらの動的な側面を理解するには実験的手法のみでは困難なため, 当研究室では分子動力学(MD)シミュレーションを用いた研究も行っています.
分子動力学(MD; Molecular Dynamics)シミュレーションとは, 経験的なポテンシャル(力場)の下に,古典力学におけるニュートン方程式を数値解析により解くことで, 注目する物質の時間発展を得て,系の動的過程(ダイナミクス)を解析する手法です. 水溶液中における蛋白質のMDシミュレーションには膨大な計算が必要なため,通常はスーパーコンピューターなどを用いて行われています.
当研究室では,MDシミュレーションを結晶構造解析によって得られた立体構造に適用することで,蛋白質のダイナミクスを解析するとともに,計算機実験から得られた新たな情報をウェットの実験にフィードバックし,生命現象の本質に迫ることを目標として研究を進めています.
MgtE細胞質ドメインの開閉機構
- "Mg2+-sensing mechanism of Mg2+ transporter MgtE probed by molecular dynamics study."Proc Natl Acad Sci U S A, 105(40) 15393-15398 (2008).PubMed: link
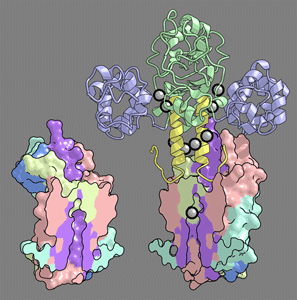 |
その結果,MgtEの構造中で「Mg2+センサー」として機能すると考えられる細胞質ドメインにMg2+が結合することで膜貫通ドメインの構造変化を誘起し,イオン透過孔を開閉してMg2+透過を制御する可能性が示唆されました.
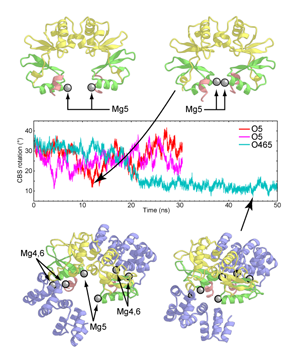 |
構造解析の結果から推定されるMgtE細胞質ドメインの構造変化機構を解明するため,MgtE細胞質ドメインのMg2+存在下・非存在下でのMDシミュレーションを行いました.そして,MgtE,イオン,水分子を陽に含む11万原子の系で計算を行い,計算機内でMg2+存在下の閉状態から非存在下の開状態への遷移を再現することに成功しました.さらに,シミュレーションの結果からは,結晶構造からはその機能が不明であったNドメイン(図・紫色部分)の役割が,細胞質ドメインの安定な閉状態形成に重要であることが示唆されました.またさらに,シミュレーションの結果から,細胞質ドメインはMg2+だけでなくCa2+も認識してしまう一方で,Na+など一価カチオンは結合しない可能性も示唆されました.
この動画のyoutubeサイト
SecYEの構造変化 ↑
- "Conformational transition of Sec machinery inferred from bacterial SecYE structures."Nature, 455 988-991 (2008).
細胞質で新規に合成されたタンパク質の膜を越えての輸送や膜への組込みは, トランスロコンSecYEを中心とした超分子複合体を介して行われます. 我々の研究室ではバクテリア由来SecYEとSecYEを特異的に認識する抗体Fab断片の複合体構造をX線結晶構造解析により3.2 Å分解能で決定しました.
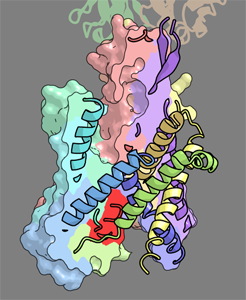 |
SecYEの基本的な構造はBergらが解明した古細菌型SecYEβ[Van den Bergら, Nature (2004)]に類似しており,SecYの内部にタンパク質の通り道となる砂時計型の空間が存在し,その空間はペリプラズム側からプラグヘリックス(図;赤色の部分)によって閉ざされています.しかし,古細菌型SecYEβと比較して,SecYE の構造は細胞質側の領域が開き,凹みが形成されていました. そこで我々は,Bergらによる閉じた構造に対し,部分的に開いた本構造を, タンパク質膜透過反応における初期段階の「プレオープン型」であるというモデルを提唱しました. また,Fab が結合している細胞質側の部位は,SecA と相互作用する保存性の高い領域であることから,Fab の結合が SecA の相互作用をミミックしており,SecYの構造変化を誘起している可能性が考えられます.
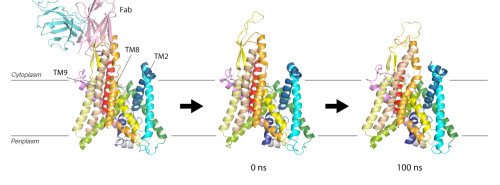 |
それではSecYEの構造は,Fabが結合していない状態では,古細菌型SecYEβと同様の閉状態に自発的に戻りうるのでしょうか.我々はこの仮説を検証するために, バクテリア由来SecYE・Fab複合体の結晶構造から,Fabをとり除いた系を初期構造とし,100ナノ秒のMDシミュレーションを行いました.その結果,バクテリア由来SecYEも,Fabが結合しない状態では閉状態に戻ることが示されました.この結果は部位特異的クロスリンク実験等の生化学的解析とも良く一致する結果でした.
(本研究におけるMDシミュレーションは理化学研究所・杉田研究室との共同研究で行われたものです)
![[XXX]](/image/tw.png)